En France, les écloseries et nurseries conchylicoles produisent majoritairement des huîtres creuses au stade naissain pour les vendre aux ostréiculteurs et proposent ainsi une méthode de culture alternative en conditions contrôlées avec la possibilité de maîtriser la qualité des eaux entrantes et sortantes. Au sein de ces établissements, le traitement de l’eau devient donc un sujet essentiel particulièrement pour le maintien d’huîtres géniteurs, des élevages larvaires et pour la production de microalgues fourrages. Le but de cette étude est de développer l’ultrafiltration pour le traitement de l’eau de mer dans ces structures avec les objectifs d’éliminer en amont les agents pathogènes et les parasites pour la pérennisation des espèces et des cultures. La fiabilité et la robustesse de l’ultrafiltration ont été éprouvées à l’échelle semi industrielle et validées sur les différentes matrices testées. Une biosécurisation des élevages est obtenue avec la protection des animaux du stade larvaire à adulte vis-à-vis d’agents pathogènes (virus OsHV1 et bactérie Vibrio aestuarianus) mais également de blooms algaux.
Les procédés de traitement des eaux n’ont cessé de se développer en aquaculture ces dernières années du fait du fort développement des structures d’élevages à terre, fermées et contrôlées. L’objectif est de s’adapter aux besoins croissants en termes de volumes et d’efficacité de traitement, de faire face à la législation environnementale ainsi qu’à la diversité des pollutions impactant la profession. En plus de garantir une efficacité de traitement, les procédés mis en œuvre dans les structures aquacoles doivent répondre aux exigences des professionnels qui les exploitent : simples d’entretien, d’utilisation, de contrôle, de performances et économiquement viables. Plus généralement, ces procédés de traitement doivent être adaptés aux exploitants et aux élevages avec pour objectif de tendre vers une production durable des animaux. La sévérité des traitements appliqués en entrée d'établissement aquacole est dépendante des contraintes liées au type d’élevage mais également de la qualité d’eau disponible. Pour protéger les animaux des différentes pollutions évoquées, les procédés mis en place se doivent de délivrer une eau de qualité constante, adaptée aux élevages, respectueuse de la croissance et du bien-être des animaux. Pour répondre à ces enjeux, plusieurs étapes sont généralement nécessaires. Les traitements communément appliqués consistent en une première étape de filtration pour éliminer les particules en suspension puis une étape de désinfection pour éliminer les organismes biologiques problématiques. Des étapes d’affinage et de traitements spécifiques peuvent être mis en place en entrée pour répondre aux exigences de qualité : aération, ajustement du pH, élimination de sous-produits de désinfection créés lors des précédentes étapes (Lekang, 2013). Si les procédés communément utilisés pour la désinfection en conchyliculture présentent des avantages comme le coût et la simplicité de mise en œuvre ou bien encore l’expérience des professionnels, aujourd’hui il n’existe pas de procédé « universel » pour la biosécurisation des établissements aquacoles. De plus ces procédés présentent les inconvénients d’une efficacité de traitement dépendante de la qualité de l’eau à traiter et possiblement la génération de sous-produits de désinfection. Les contraintes liées aux flux en entrée et sortie d’établissement conchylicole, par la variation de la composition de l'eau de mer selon les saisons ou la météo, de la charge et des volumes selon les périodes de l’année sont aussi à prendre en compte. Le développement de nouveaux procédés présentant une efficacité de traitement constante et indépendante de l’eau à traiter et ne générant pas un transfert de pollution par la création de sous-produits est indispensable. Les procédés membranaires se présentent comme une solution adaptée pour répondre à ces problématiques de traitement des eaux en conchyliculture. L’objet de cette étude est donc d’étudier l’ultrafiltration comme procédé de biosécurisation d’installations conchylicoles contrôlées vis à vis des agents pathogènes de l’huître creuse mais également dans le cas de blooms algaux.
Matériels et méthodes

Les membranes utilisées sont des membranes ALTEON™ I (SUEZ-Aquasource) d’ultrafiltration, fibres creuses multicanaux en polyethersulfone hydrophile (PES) et sont assemblées dans un module de taille semi industrielle (tableau 1).

Le pilote (figure 1) est positionné au sein de la plateforme expérimentale Ifremer mollusques marins de Bouin (PMMB) dont les missions sont entre autres l’étude de procédés de traitement d’eau pour l’optimisation de la sécurisation des productions conchylicoles. Le pilote enregistre en continu les différentes données de filtration (pressions aux différents points du pilote, température, pH, débits de filtration et de rétrolavage). En fonctionnement normal de production d’eau de mer ultrafiltrée, le pilote enchaîne automatiquement des étapes de filtration et de nettoyage par rétrolavage et quand ces derniers ne permettent plus d’obtenir une perméabilité suffisante (200 L.h-1.m-2.bar-1) un nettoyage chimique est opéré. Dans le cas de l’élimination d’agents pathogènes de l’huître creuse, virus OsHV-1 et bactérie Vibrio aestuarianus, à forte concentration, le travail sur le pilote présenté précédemment n’est pas envisageable pour deux raisons : (i) les protocoles permettant de produire les suspensions bactérienne ou virale à forte concentration pour les essais ne permettent pas d’atteindre les volumes nécessaires pour travailler à cette échelle et (ii) travailler avec des agents pathogènes de l’huître nécessite le contrôle total des effluents produits et oblige la réalisation des tests dans une zone expérimentale spécifique et isolée des élevages présents dans la PMM Ifremer de Bouin afin d’éviter leur contamination.
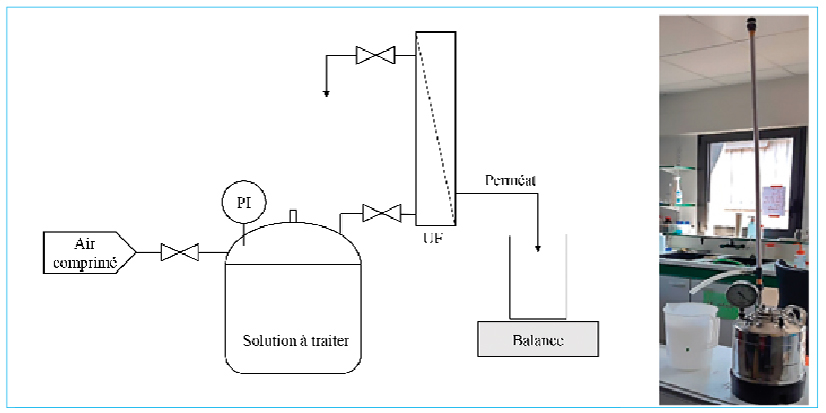
Le choix d’utiliser un système de filtration à échelle laboratoire (figure 2) s’est alors imposé dans une salle d’expérimentation prévue à cet effet, aménagée et compatible pour accueillir des expérimentations sur des organismes pathogènes de classe 2. Le module est placé sur la cuve d’alimentation contenant la solution à traiter qui sera mise sous pression en introduisant de l’air comprimé purifié jusqu’à atteindre la pression de filtration visée. Sur ces essais, dans le but de réaliser un transfert d’échelle avec le pilote de taille semi industrielle, la pression choisie correspond à la pression transmembranaire (PTM) atteinte dans les conditions de filtration imposées sur ce dernier (PTM = 0,3 bar). Comme pour les essais à échelle industrielle, la filtration s’opère en mode interne-externe et frontale mais ici, la pression est constante et le flux de perméat est suivi au cours du temps.
Résultats
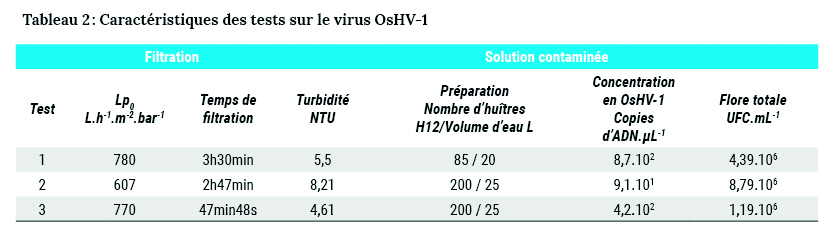
Trois expériences ont été réalisées sur le virus OsHV-1. Les caractéristiques des expériences, perméabilité initiale mesurée à l’eau déminéralisée, temps de filtration, turbidité, concentration en ADN d’OsHV-1 et en flore totale de la solution contaminée sont synthétisées dans le tableau 2 (Cordier et al., 2020a).
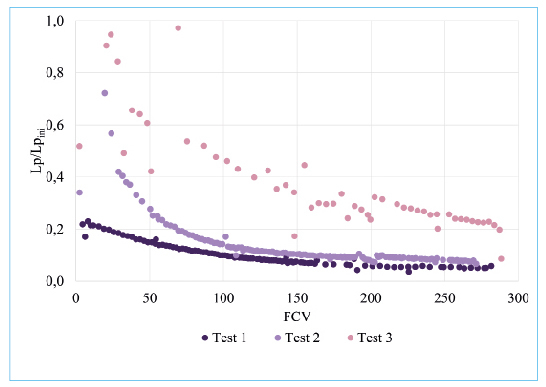
Le colmatage généré par le traitement des solutions de virus n’est pas similaire pour les 3 expériences (figure 3). La qualité des solutions virales produites, que ce soient leurs paramètres physico-chimiques, bactériologiques ou encore la concentration virale obtenue (tableau 2), variables sur les 3 essais, explique ces résultats. Le colmatage semble alors davantage lié aux paramètres tels que la turbidité et la présence de bactéries qu’à la concentration en OsHV-1 de la solution. Dans les 3 cas, la chute de perméat reste raisonnable avec des flux de perméat finaux de l’ordre de 100 L.h-1.m-2.bar-1 à partir de solutions très concentrées initialement.
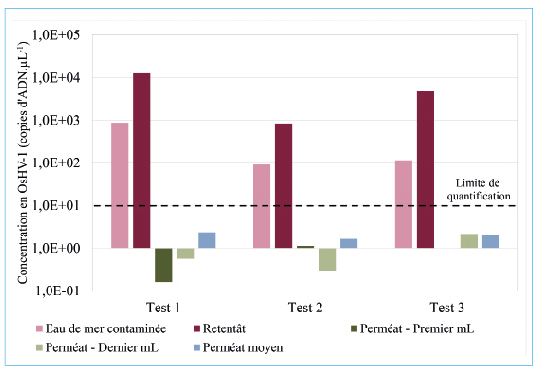
Les performances de rétention du virus sont contrôlées par des mesures de la concentration d’ADN viral OsHV-1 présent dans l’eau contaminée (EDMC), dans le retentât et les différents perméats. Plusieurs échantillons de perméat sont en effet prélevés et analysés : premiers mL, derniers mL, 4,25 premier litres, 4,25 dernier litres et perméat moyen sur la totalité du perméat receuilli. Les concentrations mesurées sur ces différents échantillons et pour les 3 expériences sont présentées figure 4. L’analyse révèle la présence du virus dans les échantillons de perméat mais à une concentration toujours inférieure à la limite de quantification de 10 copies d’ADN.µL-1. Les valeurs obtenues dans les perméats sont estimées comprises entre 0 et 4 copies d’ADN.µL-1 au maximum dans le cas du dernier mL de perméat du test 3.
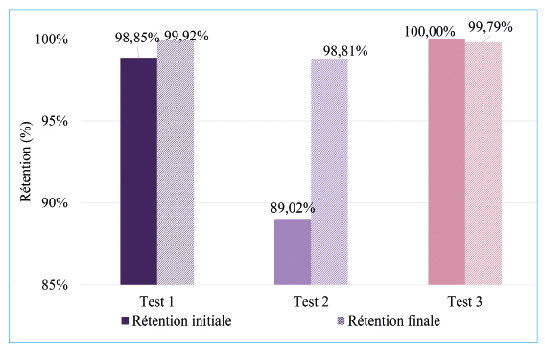
Les rétentions en début de cycle et en fin de cycle sont calculées pour les différentes expériences et présentées figure 5.
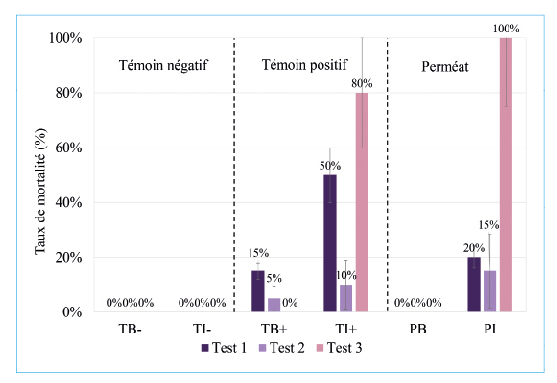
Les témoins positifs, d’injection et de balnéation, sont réalisés avec de l’eau de mer contaminée et les témoins négatifs avec une eau de mer ultrafiltrée produite par le pilote de taille industrielle. Les mortalités obtenues après 7 jours de mise en contact, pour les tests de balnéation et d’injection de naissain d’huîtres, et pour les 3 expériences, sont présentées figure 6. Lors de ces expériences, les huîtres mortes sont congelées puis leur chair est analysée en biologie moléculaire afin de déterminer la concentration en ADN viral présente et valider que leur mort était due au virus. Dans tous les échantillons analysés, une concentration supérieure ou égale à 103 copies d’ADN viral.µL-1 a été mesurée ce qui permet de confirmer que toutes les huîtres mortes lors de ces tests in vivo l’étaient à cause du virus. Aucune mortalité n’a été observée dans les témoins négatifs, que ce soit par injection (TI-) ou par balnéation (TB-). Ces huîtres ayant aussi subit une injection de 100 µL d’eau de mer n’ont pas été impactées par le protocole expérimental et ont supporté les conditions de l’expérience à 20°C dans de l’eau de mer ultrafiltrée sans apport de nourriture pendant 7 jours. Comme attendu, des mortalités sont observées pour les témoins positifs d’injection et de balnéation (TI+ et TB+). On remarque que les mortalités par injection sont plus élevées que celles en balnéation pour chaque expérience. Ces résultats sont cohérents avec ce qui a été montré par Schikorski et al. (2011). En effet, lors de l’injection le virus entre directement dans l’organisme de l’huître alors que la balnéation nécessite que l’huître filtre le milieu dans lequel elle se trouve pour permettre au virus de la contaminer. Lors de l’expérience 2, une faible mortalité est observée dans les témoins positifs par injection (TI+) qui s’expliquerait par leur âge trop élevé, supérieur à 12 mois, rendant les huîtres plus résistantes à la maladie engendrée par le virus OsHV-1. Pour l’expérience 3, les tests ont donc été réalisés sur des huîtres plus jeunes et sélectionnées pour leur sensibilité à ce virus ce qui a conduit à une mortalité moyenne de 80 % dans les témoins positifs par injection (TI+). Cependant, sur cette même expérience, aucune mortalité n’est observée dans les huîtres en balnéation, ce qui n’est pas un résultat habituel pour ce type d’expérience.
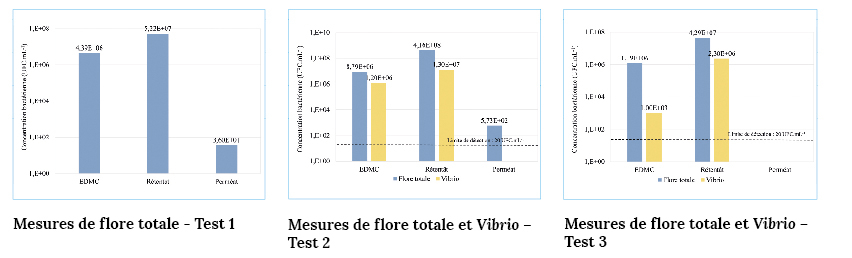
Durant les expériences avec le virus OsHV-1, l’abattement bactérien a également été mesuré par comparaison des concentrations obtenues dans les différentes eaux : eau contaminée après balnéation d’huîtres infectées par injection de la suspension virale, perméats et rétentat. Les résultats du suivi bactérien sont présentés sur la figure 7. Le suivi a été effectué par ensemencement sur milieu de culture en boite de Petri permettant de dénombrer la flore totale bactérienne marine et spécifiquement le genre Vibrio. Si aucune colonie ne se forme sur le milieu de culture, la valeur rapportée est le seuil minimal de détection soit de 20 UFC.mL-1. La membrane d’ultrafiltration permet la réduction d’au minimum 4 logs de la flore totale dans chaque expérience. Concernant le genre Vibrio, les résultats de l’expérience 1 n’ont pas pu être déterminés à cause du trop grand nombre de colonies formées sur les milieux gélosés (> 300 UFC). Des dilutions ont été réalisées pour les expériences suivantes afin de faciliter le dénombrement. Les rétentions des bactéries du genre Vibrio obtenues pour les expériences 2 et 3 sont élevées puisqu’aucune colonie ne s’est développée dans les boites de pétri correspondant aux perméats et cela pour des concentrations bactériennes initiales différentes.

Les rétentions initiales et finales ont été déterminées pour chaque expérience sur la flore totale ainsi que les abattements initiaux et finaux pour les bactéries de type Vibrio (tableau 3).

Si les essais précédents ont montré une rétention totale des bactéries du genre Vibrio, il est essentiel de réaliser une étude spécifique avec la bactérie pathogène Vibrio aestuarianus GFP, modifiée pour être détectable par cytométrie en flux sans ajout de marqueur, et résistante à un antibiotique, la kanamycine (qui permet d’obtenir des cultures spécifiques à cette bactérie). Trois tests de filtration, synthétisés Tableau 4 ont ainsi été réalisés.
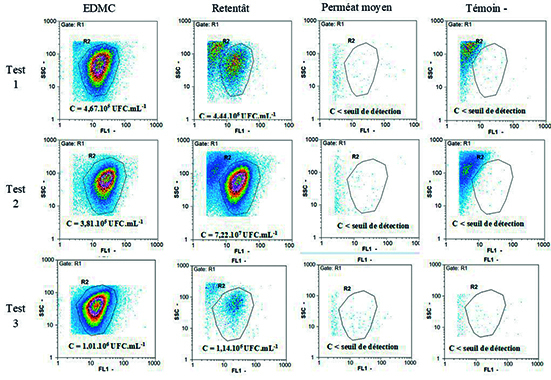
Les évolutions du flux en fonction du FCV obtenus sur les 3 tests, montrent un flux de perméat stabilisé autour de 200 L.h-1.m-2 pour un FCV allant jusqu’à 250. Le colmatage est plus modéré que dans le cas du traitement des solutions virales. Ce résultat s’explique par la qualité de la matrice contenant les microorganismes. Dans le cas du virus la solution contaminée était préparée à partir d’huîtres infectées qui complexifiaient la matrice par l’apport de bactéries, fèces et chair en décomposition, ce qui n’est pas le cas de la solution bactérienne. Afin de valider les performances de rétention, les échantillons (eau de mer contaminée, perméat moyen, retentât, témoin négatif) ont été analysés par cytométrie en flux. Les résultats ont été reportés dans la figure 8. Pour tous les perméats analysés sur les 3 tests, la concentration mesurée est inférieure au seuil de détection de l’appareil (100 UFC.mL-1). Dans le cas des tests 1 et 2, une deuxième population est observée hors zone R2 mais celle-ci provient de l’eau de mer ultrafiltrée et autoclavée utilisée pour préparer les solutions bactériennes, comme en témoignent les cytogrammes des Témoins.
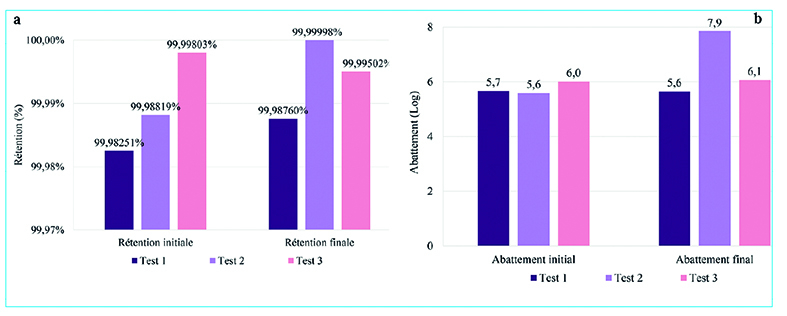
Les rétentions et abattement initiaux et finaux des 3 expériences sont présentés figure 9. Pour rappel ces valeurs ont été déterminées à partir de la limite de détection de la méthode par cytométrie en flux, c’est-à-dire 100 UFC.mL-1 et elles sont donc sous-estimées.
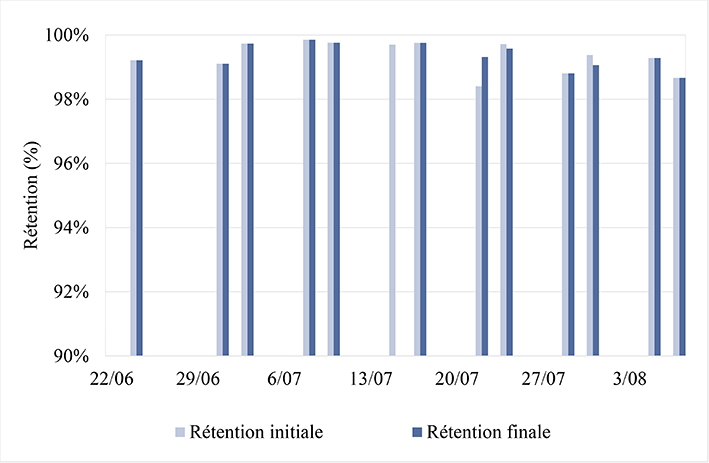
L’objectif de ces essais est de valider l’utilisation de l’ultrafiltration pour la désinfection des eaux en entrée d’écloserie/nurserie à échelle semi industrielle. Les performances hydrauliques du procédé sont donc suivies sur plusieurs mois et la rétention de la flore totale et des bactéries de types Vibrio présentes naturellement dans l’eau alimentant le pilote sont évaluées. Les performances de rétention de la flore totale sont présentées figure 10. Les mesures ont été réalisées en début (perméat initial) et en fin de cycle de filtration (perméat final). La rétention de la flore totale est supérieure à 98 %, traduisant ainsi l’efficacité de la membrane. La concentration en flore totale dans les perméats se situe en dessous du seuil de détection de la méthode par ensemencement sur milieu spécifique (20 UFC.mL-1), quelle que soit la concentration bactérienne de l’alimentation. Cette prise en compte de la limite de détection, couplée à des concentrations dans l’alimentation de l’ordre de 104 UFC.mL-1, explique des abattements de seulement 99 %, même si aucune colonie ne se développait sur les milieux de culture.
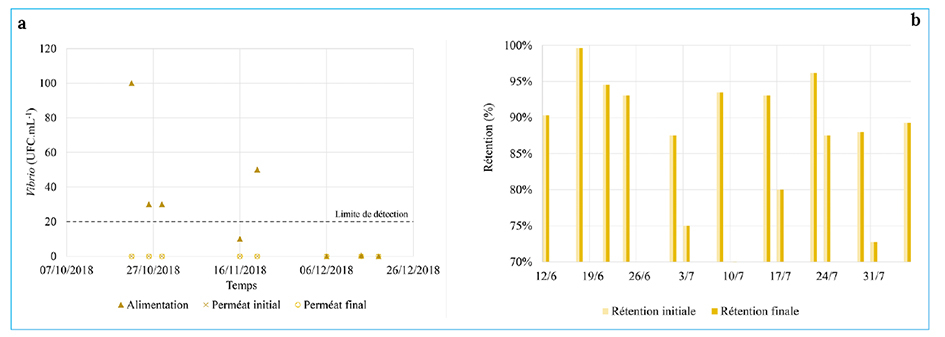
Sur les deux mois de suivi, aucune bactérie du genre Vibrio n’a été détectée sur les analyses des échantillons de perméat, initial et final. La concentration fixée pour calculer la rétention (figure 11) est de 20 UFC.mL-1 qui correspond à la limite de détection justifiant les rétentions faibles obtenues. Les concentrations en amont des bactéries du genre Vibrio sont restées faibles pendant le suivi (200 UFC.mL-1 en moyenne). Quelques pics ont été observés dans l’alimentation le 21/06 avec 5.220 UFC.mL-1 et le 24/07 avec 520 UFC.mL-1. Malgré ces fluctuations de concentrations bactériennes, aucune concentration n’a pu être quantifiée dans les perméats. L’ultrafiltration assure la rétention des bactéries Vibrio indépendamment de la concentration initiale, de la perméabilité de la membrane et des paramètres physico-chimiques de l’eau de mer en alimentation. Des résultats similaires amenant à la même conclusion ont été obtenus en automne-hiver (figure 11).
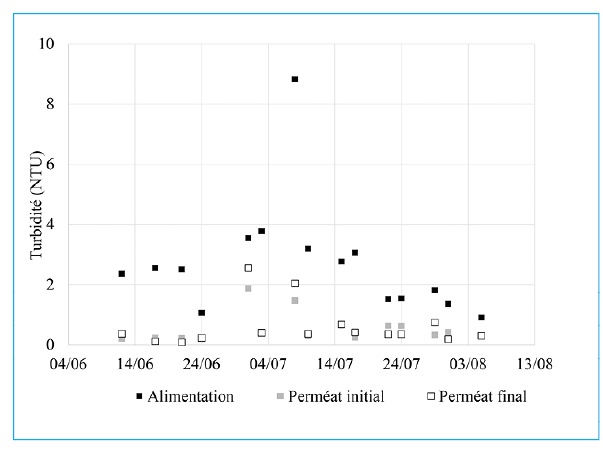
Les paramètres physico-chimiques de l’alimentation et des perméats initiaux et finaux ont été suivis pendant les 2 mois. Comme attendu le pH, la salinité, la température et le dioxygène dissous ne sont pas impactés par l’ultrafiltration puisque les valeurs sont constantes entre l’alimentation et le perméat. Inversement, en figure 12, un abattement de la turbidité est obtenu avec le procédé d’ultrafiltration puisque celle-ci se situe majoritairement en dessous de 1 NTU dans les perméats quelle que soit la turbidité de l’alimentation (entre 1 et 9 NTU).
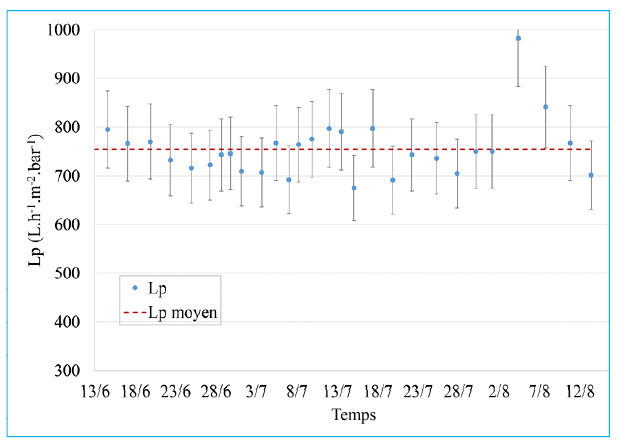
Une augmentation de la turbidité a un impact sur la vitesse de colmatage mais celle-ci n’a pas d’effet sur la récupération de la perméabilité initiale après un nettoyage chimique. En effet, comme présenté figure 13, la perméabilité initiale moyenne est de 750 L.h1.m².bar-1 et celle-ci est restée constante sur la durée de l’étude et sur les différentes qualités d’eau.
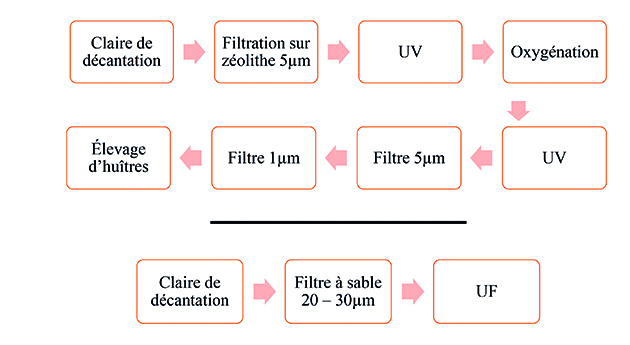
En juillet 2019, un dépôt rougeâtre a été observé dans les bacs d’élevages d’huîtres alimentés en eau de mer provenant d’une claire de décantation et subissant plusieurs étapes de traitements présentés figure 14. Cette claire alimente également le pilote industriel d’ultrafiltration via un autre réseau. L’impact de cette pollution sur le pilote de filtration, attribuée à un bloom micro algal au sein de la claire (phénomène courant aux saisons printanières et estivales), a été étudié et comparé aux capacités de rétention du réseau d’eau alimentant les élevages.

Le premier jour du « bloom », une faible quantité de dépôt a été observée dans les eaux de rétrolavage du pilote d’ultrafiltration et dans sa cuve d’alimentation. La figure 15 illustre l’eau récupérée au fond de la cuve d’alimentation du pilote (a). Il a été remarqué que le dépôt rougeâtre décantait rapidement après 5 minutes (b) puis quasi complètement après 24 heures (c).
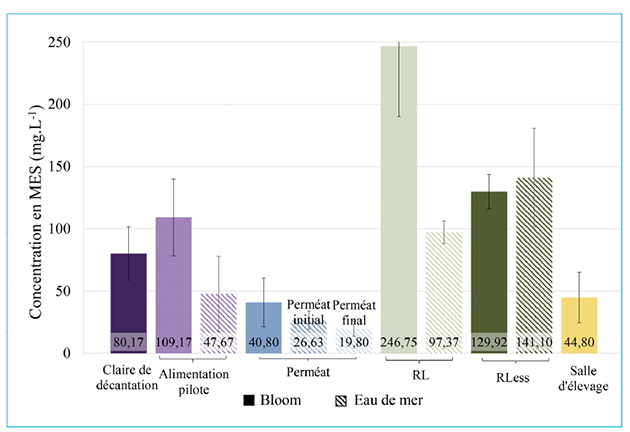
Lors du bloom, l’impact est donc observé avec un décalage de 24 h environ. Le temps entre 2 nettoyages chimiques est fortement réduit en passant à seulement 29,5 puis 18,1 h au lieu de 48-72 h initialement selon la qualité de l’eau entrante. A noter que pour considérer cette technologie comme viable économiquement, la valeur limite de temps entre deux nettoyages chimiques est de 12 h. Une fois le bloom terminé (vidange de la claire de pompage et apport d’une nouvelle eau de mer), les conditions d’ultrafiltration sont revenues à la normale. La concentration en matières en suspension a également été mesurée sur plusieurs échantillons pour étudier l’impact du bloom sur les procédés de traitement de l’eau alimentant la micronurserie de la structure conchylicole de Bouin (figure 16). On constate que lors du bloom, c’est le perméat de l’ultrafiltration qui présente la plus faible concentration en MES en comparaison avec une eau de mer ayant reçu 3 étapes de filtration successives dont une à 1 micron. L’ultrafiltration permet la rétention de plus de 50 % des MES mesurées dans l’alimentation quelle que soit la qualité d’eau qui alimente le procédé. Les performances du procédé d’ultrafiltration, rétention et performances hydrauliques n’ont donc que peu été impactées durant le bloom algal.

Les prélèvements réalisés sur ces différents points montrent une différence significative de qualité : un dépôt est présent dans les eaux après filtration et UV alimentant les salles d’élevage, contrairement au perméat. Si la photo (figure 17) ne révèle pas la présence de dépôt dans l’eau d’alimentation du pilote, celles des rétrolavages permettent de confirmer la pollution dans l’eau en amont des membranes.

Une étude granulométrique a pu être réalisée sur les MES montrant que la majeure partie des particules ont une taille inférieure à 0,02 µm (36 %), entre 0,02 et 1 µm (21 %), entre 1 et 5 µm (26 %) et supérieure à 5 µm pour le reste (17 %), ce qui explique les performances supérieures de l’ultrafiltration face à des procédés conventionnels au sein d’établissements conchylicoles. Par ailleurs, lors d’un épisode de ce type, la saturation de systèmes classiques de filtration tels que les filtres à sable conduit au « perçage » du filtre, c’est-à-dire qu’un passage préférentiel est généré au sein du lit de sable avec une diminution drastique des performances de filtration. Dans ces conditions, le passage d’éléments indésirables, plus gros, est facilité, ce qui a été confirmé au moment du bloom algal avec des observations au microscope montrant la présence d’une quantité significative d’organismes parasites, présentés figure 18, tels que des copépodes, des spicules d’éponges, des larves d’huîtres ou encore des nématodes. A contrario, ces éléments indésirables n’ont pas été retrouvés dans les eaux de perméat mais bien présents dans les eaux de rétrolavages du pilote d’ultrafiltration montrant ainsi l’avantage de cette technologie en cas de pollution aigüe.

