Le traitement industriel des eaux est un secteur en constante évolution à tous les niveaux.
Introduction
- Besoin d’avoir des alternatives de traitement chimique ayant une grande efficacité et un faible coût de mise en marche ; la réduction du coût du traitement chimique ne peut en aucun cas entraîner la perte de ses propriétés ou la diminution d’une de ses fonctions pour lesquelles il est conçu. C’est pourquoi, les charges d’inhibition, de type antitartre ou anticorrosif, doivent être équivalentes ou supérieures à celles présentes dans les inhibiteurs traditionnels et largement utilisés dans l’industrie.
- Restrictions croissantes dans le type et la concentration des principes actifs des inhibiteurs dans les rejets industriels ; dans le contexte actuel, il est de plus en plus nécessaire de disposer d’inhibiteur ayant un impact environnemental nul ou très faible et une grande biodégradabilité.
Traitements anticorrosifs dans les circuits fermés de refroidissement
- L’ion molybdate présente un taux de toxicité faible sur la base des critères définis par la LD50 [5]. Toutefois, l’aspect le plus préoccupant dans l’utilisation de ce principe actif anticorrosif dans les eaux industriels est son accumulation dans les boues des réacteurs biologiques dans les stations d’épuration. Ces boues, transformées, sont utilisées pour la fabrication des denrées animales. Un excès de molybdate dans les aliments pour animaux peut entraîner des interférences avec les fonctions des organes vitaux tels que les reins ou le foie chez les animaux qui en sont nourris [6].
- L’ion nitrite agit comme nutriment de certaines populations microbiologiques, qui le dégradent en nitrate, ammoniac et azote. Le nitrate, à son tour, est dégradable par une autre population de micro-organismes à l’ammoniac. Outre la perte d’inhibiteur que cette dégradation microbiologique entraîne (en l’absence d’un bon programme de traitement biocide), l’apparition d’azote ammoniacal n’est pas souhaitable dans les systèmes à base de cuivre et leurs alliages. De plus, la toxicité de la DL50 [5] est supérieure à celle de l’ion molybdate et des autres inhibiteurs utilisés dans les circuits fermés de refroidissement.
- L’ion nitrite, ainsi que les amines, sont des précurseurs de la formation de nitrosamines, des composés potentiellement cancérigènes. L’exposition humaine à ces ions peut également être la cause du développement de la maladie de la méthémoglobinémie.
- En conséquence, l’ion nitrite et l’ion molybdate font tous deux partis de la liste des substances polluantes couvertes par la législation en vigueur sur les rejets publics.
- L’ion molybdate réagit avec l’ion ferreux (Fe2+) dérivé de la réaction d’oxydation du fer métallique avec l’oxygène pour former des complexes solubles. Ceux-ci sont ensuite oxydés par l’oxygène dissous présent dans l’eau pour former des complexes de faible solubilité sous forme de couches passives sur les surfaces métalliques du système.
- L’ion nitrite, catalyse la formation des structures robustes d’oxyde de fer comme décrit dans l’équation 1. Contrairement au mécanisme qui est établi avec l’ion molybdate, l’ion nitrite ne nécessite pas la présence d’oxygène pour initier la formation de couches protectrices. De ce fait, la présence d’oxygène doit être évitée.
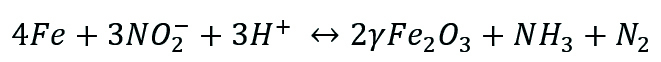
Équation 1
- De faibles dosages conduisent à des adsorptions hétérogènes sur les surfaces métalliques et donc à la présence de discontinuités de la couche protectrice. Les processus de corrosion, dans les zones non protégées, sont particulièrement sévères et peuvent déboucher sur des fissures d’une certaine profondeur.
- Des dosages élevés peuvent entraîner une augmentation du transport d’oxydes dans le circuit. La nature adsorbante du principe actif utilisé peut entraîner la désorption d’oxydes métalliques présents sur les surfaces du système. Ce qui peut être vu initialement comme un effet dispersant ou nettoyant peut être particulièrement problématique dans les circuits à faible taux de renouvellement d’eau et au niveau des échangeurs de chaleur avec une faible section de passage où des bouchons peuvent se produire en raison de ce phénomène.
- Parallèlement, le surdosage des substances actives filmantes de nature hydrophobe peut conduire à la formation d’agrégats avec des effets nocifs sur les lignes de circulation d’eau et sur l’installation elle-même. La formation de films sur les capteurs électrochimiques peut conduire à des dysfonctionnements et à des actions de contrôle inadéquates dûes à l’absence de rétro-alimentation adéquate.
- Faible/zéro toxicité sans risque de bioaccumulation [6] de composés nocifs dans les tissus des organismes vivants.
- Présentant une biodégradabilité significative, afin de minimiser l’impact environnemental.
- Composés stables dans les conditions de fonctionnement ; absence de risques associés à la dégradation en sous-produits ayant des effets nocifs sur la métallurgie du système.
- Également actifs dans les circuits fermés étanches (en l’absence d’oxygène) ou dans les circuits à pression atmosphérique.
- Possibilité de surveillance en ligne pour un contrôle total du traitement et de la numérisation des informations du circuit.
- Rapport coût - efficacité optimum pour représenter une alternative réaliste aux inhibiteurs traditionnels.
- Contrôle de la corrosion par la formation de complexes à faible solubilité ; les substances actives contenues dans la formulation réagissent avec le métal des surfaces à traiter. A la concentration appropriée d’inhibiteur, le rapport entre ion métallique (Me) et composé ligand (L) conduit à la formation de complexes à faible solubilité qui se déposent sur les surfaces à protéger (eq. 2)
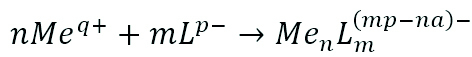
Équation .2
- Certains inhibiteurs formant ces complexes présentent une gamme de contrôle dans leur dosage très étroite. C’est-à-dire à des taux L/Me légèrement supérieurs aux valeurs optimales, les complexes formés ont une solubilité élevée, ce qui permet d’accélérer les processus de corrosion. Les principes actifs anticorrosifs inclus dans AdicTech 564 permettent une gamme de contrôle moins stricte sans effets indésirables en cas de surdosage.
- En raison de la structure de la chaîne moléculaire, la solubilité des complexes formés est adaptée pour que leur dépôt n’ait lieu que sur les surfaces métalliques à protéger. La formation de complexes insolubles a une portée minimale dans la matrice d’eau. Des composés avec moins d’atomes de carbone dans la chaîne conduisent à la formation de complexes plus solubles et moins capables de bloquer les surfaces avec un processus de corrosion actif.
- La formation de couches protectrices se produit non seulement par le biais du mécanisme décrit ci-dessus, mais également par l’adsorption de principe actif sur les éventuelles couches d’oxyde déjà déposées sur les surfaces métalliques. Cette adsorption est particulièrement intéressante car elle empêche la dépassivation des couches d’oxyde formé même en présence d’ion chlorure et/ou sulfate.
- Aucune des substances actives anticorrosifs contenues dans la formulation ne contribue à l’augmentation du taux de phosphore ou d’azote dans l’eau. Ainsi, un rejet éventuel d’eau traitée avec AdicTech 564 n’augmente pas le risque d’eutrophisation. Par conséquent, lorsque le rejet est effectué dans un canal présentant ce risque, ou lorsque les exigences de rejet l’exigent, il est particulièrement intéressant de doser des produits anticorrosifs de la gamme Adicgreen ; respectueux de l’environnement, hautement biodégradables, présentant une faible toxicité pour l’homme et les systèmes aquatiques et un bon rapport coût-efficacité par rapport aux anticorrosifs traditionnels.
Cas d’étude
Introduction et objectifs
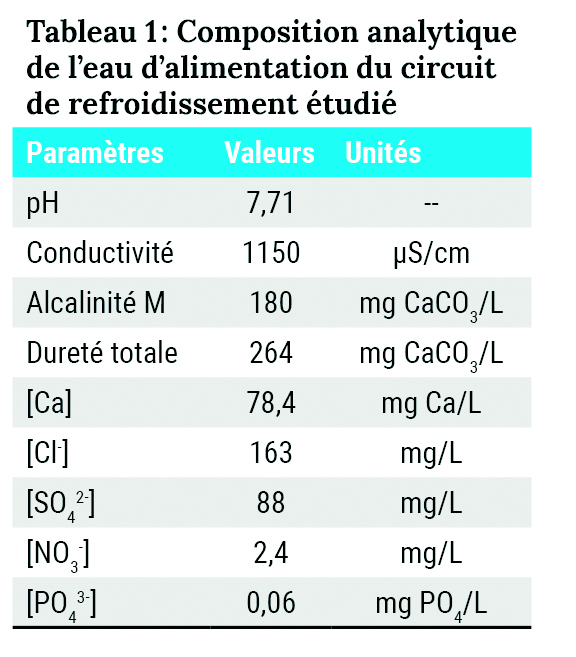
Le circuit de refroidissement est alimenté par une eau adoucie pour minimiser le risque d’incrustation de carbonate de calcium dans les zones où la température est la plus élevée. Sa composition analytique est détaillée dans le tableau 1.
Résultats
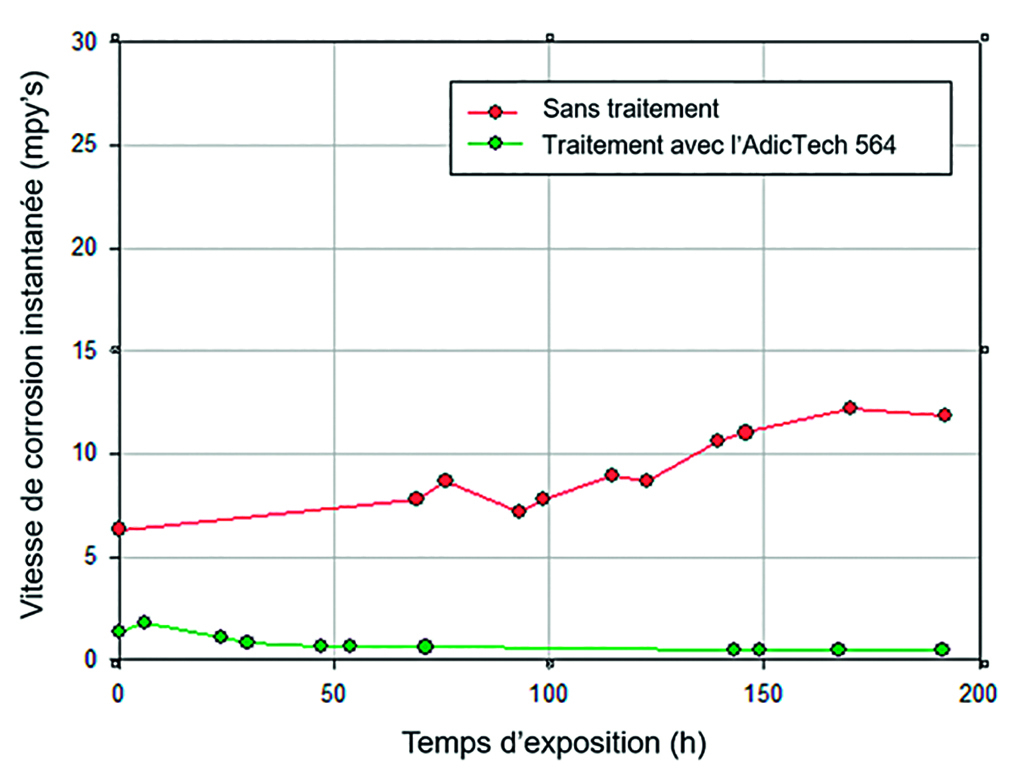
La figure 1 montre l’évolution (en laboratoire) de la vitesse de corrosion de l’acier carbone dans 2 scénarios, déterminée à partir de capteurs de corrosion LPR (Linear Polarization Resistance) [1,9] avec deux électrodes cylindriques en acier d’approximativement 1” de longueur et une superficie d’exposition proche de 4,8 mm² :
- a) Exposition à l’eau d’alimentation du circuit (dont la composition est détaillée dans le tableau 1) sans traitement chimique anticorrosif.
- b) Exposition à la même eau, cette fois-ci traitée avec AdicTech 564.
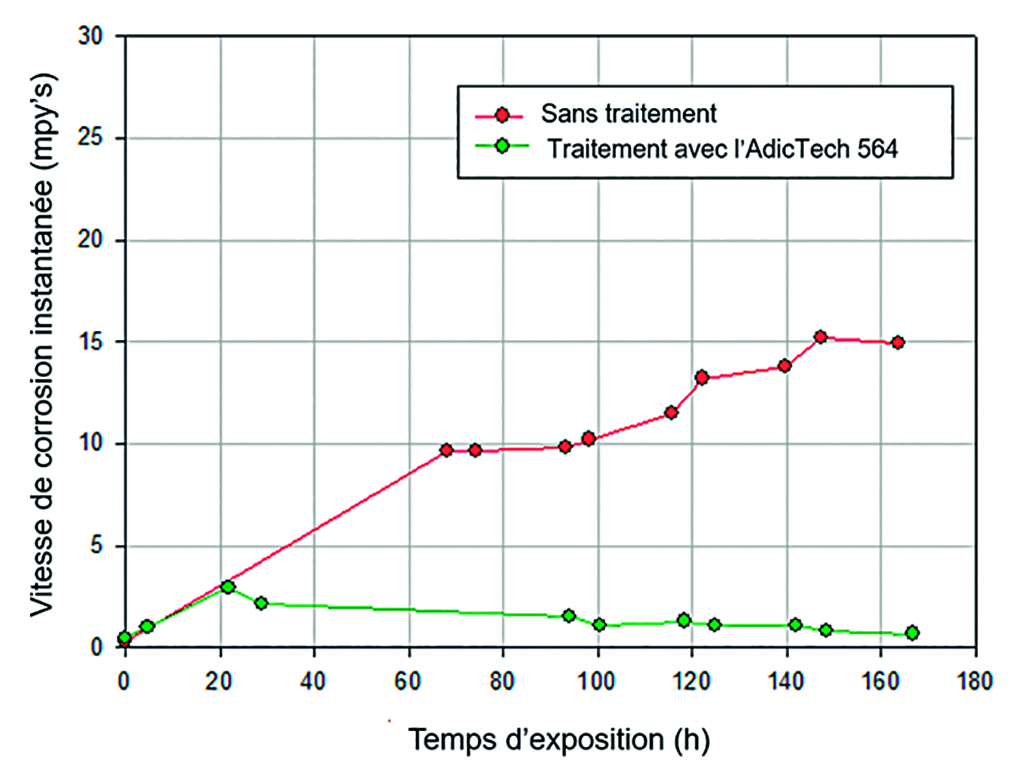
Les traitements chimiques composés d’ion molibdate (et certaines combinaisons avec des nitrites) comme principes actifs anticorrosifs, nécessitent une augmentation du dosage en présence de l’augmentation de certaines concentrations d’espèces aggressives comme l’ion chlorure et sulfate. Ceci est dû à la concurrence qui s’établie entre la formation de complexe du fer avec l’ion molybdate face au chlorure et/ou sulfate de fer. Cette augmentation du dosage à un impact environnemental considérable sur le flux de rejet de l’usine. La figure 2 montre l’évolution de la vitesse de corrosion d’acier carbone par le même système expérimental. Dans ce cas, l’eau utilisée présente une concentration en ion chlorure de 300 mg/L, en doublant la concentration mesurée dans l’eau d’apport du circuit. La vitesse de corrosion de l’acier réalisée dans une eau sans traitement chimique atteint des valeurs proches de 15 mpy’s, supérieures aux valeurs pour une concentration en ion chlorure de 160 mg/L. La vitesse de corrosion de l’acier pour une eau de la même composition analytique traitée avec l’AdicTech 564 résulte aux mêmes résultats que pour les ions chlorures inférieurs, soit une vitesse de corrosion inférieure à 0.5 mpy’s. Ceci indique que pour cette gamme de concentration d’opération (150 – 300 mg Cl/L), il n’est pas nécessaire d’augmenter la dose d’inhibiteurs contrairement aux inhibiteurs traditionnels. Expérimentalement, comme vu pour de plus faibles concentrations d’ion chlorure, une augmentation de la vitesse de corrosion est observée dans le système traité avec AdicTech 564, causé par le début du mécanisme de protection que présente le produit.
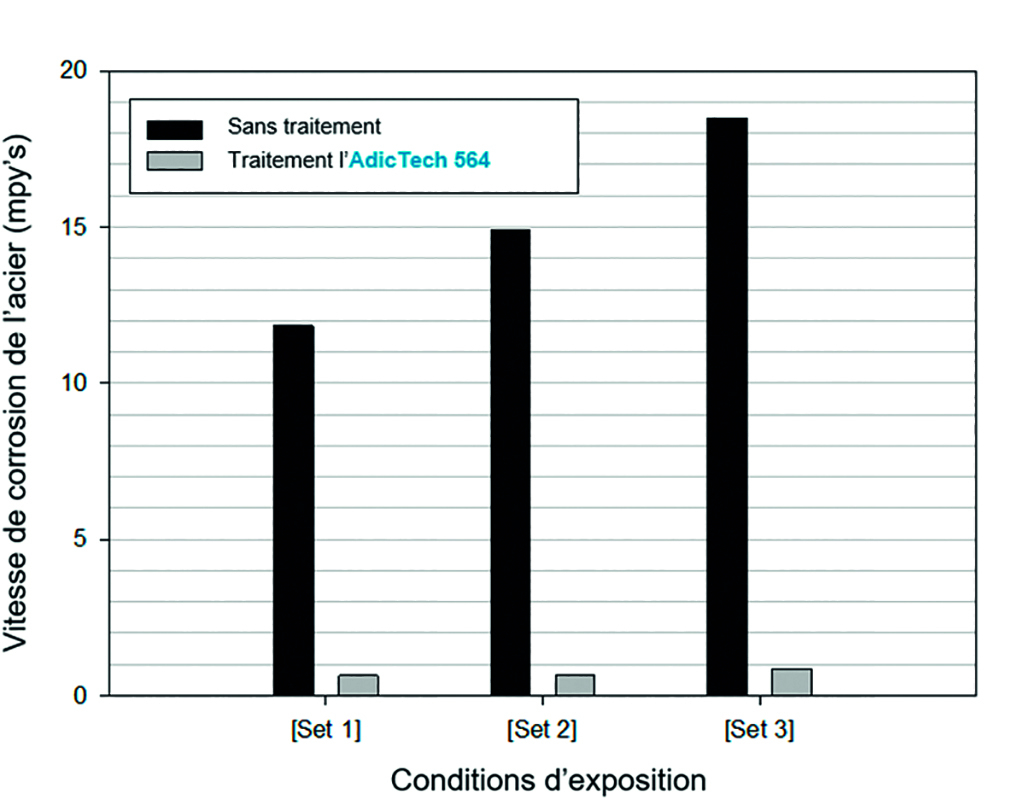
Parallèlement, et à titre comparatif, la figure 3 montre les vitesses de corrosion mesurées sur une période d’exposition de 10 jours déterminées par Standard Test Method for Corrosivity of Water in the Absence of Heat Transfer (Weight Loss Method) - [8]) pour 3 scénarios distincts :
- [Set 1] ; Eau de recirculation de composition détaillée dans le tableau 1, c’est à dire, eau réelle de l’alimentation du circuit de refroidissement.
- [Set 2] ; Eau de recirculation de composition détaillée dans le tableau 1, à l’exception de la concentration en ion chlorure qui est doublée par 2 (300 mg Cl/L).
- [Set 3] ; Eau de recirculation de composition détaillée dans le tableau 1, à l’exception de la concentration en ion chlorure et sulfate, qui ont des valeurs pour chacun de 300 mg/L.
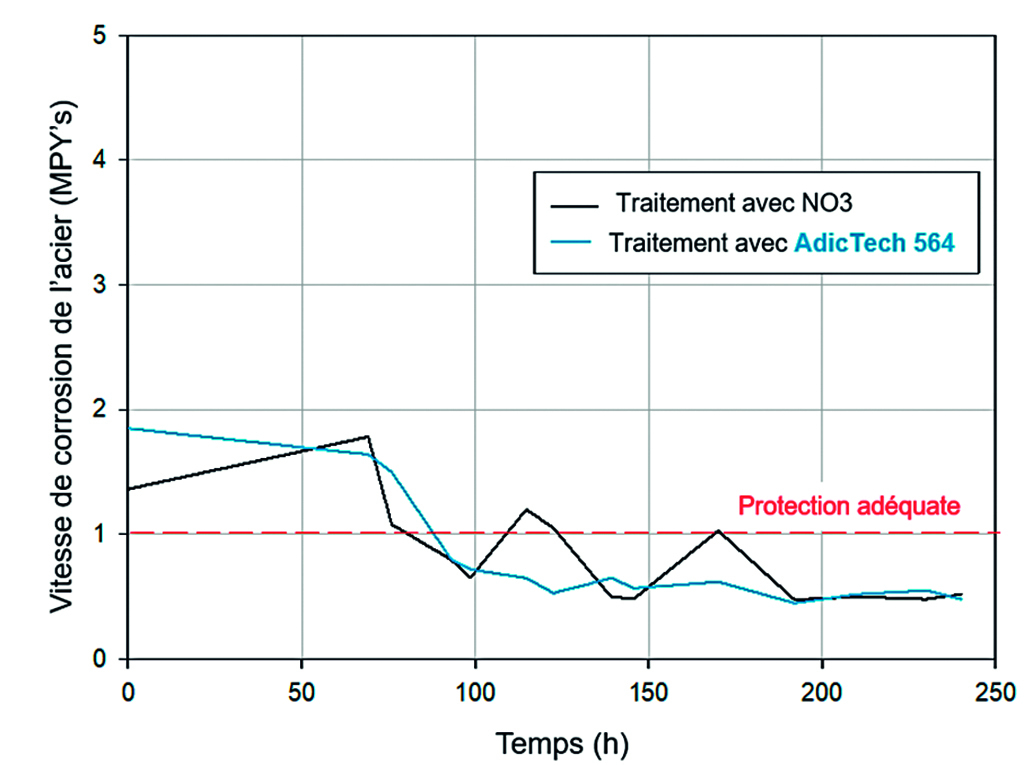
Le circuit étudié dispose d’un système Adicontrol pour le contrôle et la motorisation physique – chimique de l’eau qui permet une connection en temps réel avec le process et ses principales variables. Celles ci inclues la mesure de la vitesse de corrosion instantanée de l’acier carbone à partir des électrodes LPR décrits antérieurement. Cette mesure permet la comparaison, dans les conditions du process, de la nouvelle gamme d’inhibiteurs développée (AdicTech 564) face au traitement antérieur, inhibiteur composé d’ions nitrites principalement comme principe actif anticorrosif. La figure 4 montre l’évolution de la vitesse de corrosion pour une période de 240 heures pour les deux inhibiteurs, dans chaque cas en débutant avec de nouvelles électrodes LPR neuves, c’est à dire, non passivées. Les mesures correspondent au suivi à différentes étapes du traitement du circuit ; quand le circuit était traité à base de nitrite comme anticorrosif et actuellement avec l’AdicTech 564. Dans chacun des cas, le circuit fonctionne avec des conditions nominales.
Conclusions


